[라포르시안] 정부가 혁신성장 확산을 위해 의료기기 분야 규제혁신 방안으로 체외진단기기의 신의료기술평가를 생략하는 방안을 추진하는 가운데 기존 체외진단기기 제품 5건 1건이 신의료기술평가 과정에서 탈락하는 것으로 나타났다.
15일 국회 보건복지위원회 소속 윤소하 의원(정의당)이 한국보건의료연구원과 식품의약품안전처로부터 받은 자료에 따르면 최근 3년 간 식약처가 허가한 전체 의료기기 중 34%가 허가 취소·취하돼 시장에서 퇴출됐으며, 신의료기술평가 단계에서 탈락한 체외진단의료기기 비율이 21.8%에 달했다.
현재 의료기기는 식약처의 제품허가를 거쳐 건강보험심사평가원이 요양급여 대상 여부를 판단하고, 신의료기술일 경우 한국보건의료연구원의 신의료기술평가를 거쳐 시장으로 진입한다.
정부는 지난 7월 체외진단의료기기의 경우 안전성에 우려가 없기 때문에 식약처의 제품허가 후 곧바로 시장 진입이 가능하게끔 하고 사후 평가하는 식의 포괄적 네거티브 규제를 골자로 하는 '의료기기 분야 규제혁신 및 산업육성 방안'을 발표했다.
그러나 체외진단의료기기 제품이라고 안전성 우려가 없다는 식으로 단정할 수 없다.
2016년 이후 체외진단의료기기에 대한 신의료기술평가 현황을 살펴보면, 총 229건의 신청 건 중 42.3%인 97건이 시장으로 진입했지만 50건(21.8%)은 비승인돼 시장 진입에 실패했다.
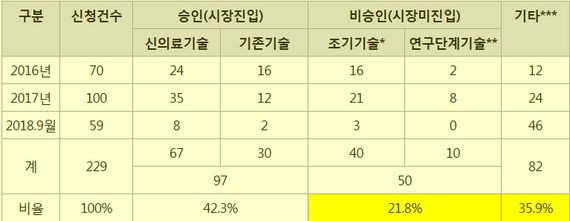
비승인 사유는 의료기술의 안전성 및 유효성을 평가하기에 연구결과가 부족한 경우가 40건이었고, 안전성 또는 유효성이 아예 확인되지 않는 의료기술이 10건이었다.
체외진단의료기기에 대해 신의료기술평가 절차를 면제할 경우 기존에 안전성이 확인되지 않은 제품이 시장에 진입할 수 있다는 의미다.
윤소하 의원은 “이미 신의료기술평가 과정에서 안전성과 유효성이 확인되지 않아 탈락한 체외진단기기가 20%가 넘는데도 불구하고, 앞으로 모든 체외진단의료기기에 대해 신의료기술평가 단계를 생략시키겠다는 것은 국민건강과 안전을 책임져야할 정부가 책임을 방기하는 것"이라고 지적했다.

