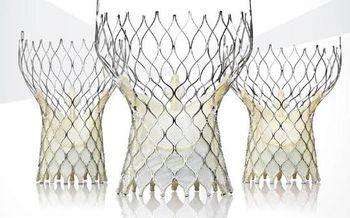
코어밸브는 개심술을 받을 수 없는 대동맥 판막 협착증 환자들을 위한 카테터 기반의 대동맥 판막 치환술 시스템이다.
FDA는 코어밸브에 대해 미국 내 임상결과 검토 후 독립적 의료기기 자문패널의 검토를 면제하고 해당 제품을 승인했다.
임상연구 결과 코어밸브는 안전성과 효과가 확인됐다.
일차 연구목표인 시술 1년 후 환자 사망 및 심각한 뇌졸중 발현률 부분에서 FDA와 공동으로 설정한 목표치보다 40.7퍼센트가 낮은 25.5%(p<0.0001)를 기록했다.
시술 1개월 후 뇌졸중 발현률은 2.4%였으며, 시술 1년 후에도 4.1%에 머물렀다.
코어밸브로 시술받은 환자의 75.6%는 시술 1년 후에도 생존했다.
또한 미국 임상의 연장선에서 진행된 지속적 접근 연구에서는 환자 생존 및 뇌졸중 발현률 부분에서 보다 우수한 결과가 나타났다 .
이 연구의 공동 선임 연구자인 베스 이스라엘 디커니스 메디컬센터 제프리 포프마 박사는 "판막 치환술에 있어 뇌졸중과 밸브 누출은 가장 우려스러운 합병증"이라며 "코어밸브는 카테터 기반의 판막 치환술에 있어 새로운 기준을 세웠다"고 평가했다.
포프마 박사는 "코어밸브의 미국 임상은 그 디자인이 매우 엄격했으며 최선의 임상시험 실시지침을 따랐다. 이 연구 결과는 카테터 기반의 대동맥 판막 치환술에 있어 최적의 결과 기준을 재정립했으며, 해당 환자들이 의학적으로 상태가 매우 복잡하고 극도로 쇠약한 상태임을 고려하면 특히 주목할만한 결과"라고 덧붙였다.
박진규 기자
hope11@rapportian.com
다른기사 
