연세대 송재환 교수·이은우 박사
연세대 송재환 교수와 이은우 박사가 진행한 이번 연구는 교육과학기술부와 한국연구재단이 추진하는 중견연구자지원사업(도약연구)의 지원으로 수행됐다.
연구결과를 담은 논문은 ‘네이처’의 온라인 자매지인 ‘Nature Communications’최신호(7월 31일자)에 게재됐다.
세포자기사멸(apoptosis)은 특정한 상황에서 동물 세포가 스스로를 신속하고 깨끗하게 죽여 없애는 프로그램화된 과정(programmed cell death)으로, 정상적인 생명체의 배아발생 단계에서부터 필수적으로 작용하면서 정상세포가 암세포로 변하는 것을 막는 중요한 원리다.
세포자기사멸은 다양한 신호로 활성화되는데, 크게 세포 외부로부터 시작되는 외인성 세포사멸과 세포 내부에서 시작되는 내인성 세포사멸로 분류된다.
외인성 세포사멸은 세포사멸수용체(TNFα, TRAIL, FAS 리간드 등)에 의해 활성화되고, 이 수용체들의 공통 연결(adaptor) 단백질(FADD)이 세포사멸수용체를 활성화해 세포사멸을 유도한다고 알려져 왔다.
하지만 FADD 단백질의 활성이 어떻게 조절되는지는 거의 밝혀지지 않았다.
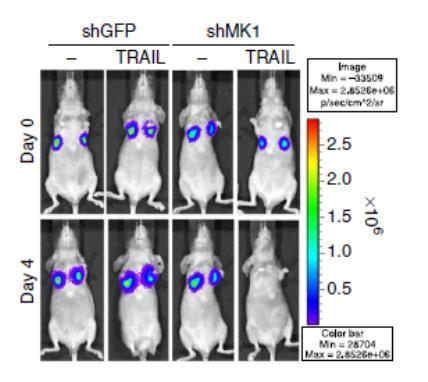
송재환 교수 연구팀은 이번에 FADD 단백질을 분해하는 원리를 처음으로 규명해, MKRN1(마코린 원) 단백질을 통해 FADD 단백질의 활성을 조절하는데 성공했다.
연구팀은 유방암과 자궁암 환자 샘플에서 MKRN1 단백질의 양이 정상세포에 비해 암세포에서 증가됐고, 반면에 FADD 단백질은 암세포에서 감소했음을 확인했다.
또한 FADD 단백질이 많은 세포주에 약물(TRAIL)로 항암치료를 하면 종양이 더욱 빠르게 감소하는 등 치료효과가 크게 증가한다는 사실을 동물실험(생쥐)을 통해 검증했다.
송재환 교수는 “이번 연구성과는 FADD 단백질의 분해원리를 처음으로 밝혀낸 것으로, MKRN1 활성 저해제를 개발할 경우 다른 항암요법과 병행해 치료효과를 획기적으로 높일 수 있을 것으로 기대한다”고 말했다.

