[라포르시안] 국내 연구진이 치매 원인으로 알려진 ‘타우 단백질’이 뇌 속에서 섬유화되는 분자 수준의 기전을 최초로 규명해 새로운 개념의 알츠하이머 치매 치료제 개발 가능성을 제시했다.
타우 단백질은 대표적인 알츠하이머병인 단백질로서 알츠하이머 환자의 뇌에서 응집되고 섬유화돼 비정상적으로 축적된다.
한국보건산업진흥원(원장 차순도)은 이민재 서울의대 교수 등 다학제 연구팀과 김준곤 고려대 교수 연구팀이 알츠하이머성 치매 병인으로 밝혀진 타우 단백질의 섬유화 과정과 신경독성 물질 형성 원리를 최초로 입증했다고 4일 밝혔다.
진흥원에 따르면 이번 연구는 알츠하이머 병인인 타우 단백질 조각이 뇌 신경세포 내부로 침투하는 과정과 시냅스 기능 억제 기전, 동물의 기억력 감퇴 및 뇌 조직 사멸에 끼치는 영향 등 그간 규명되지 않았던 타우 단백질의 섬유화 현상을 구체적으로 규명했다.
치매의 대표적 유형인 알츠하이머병의 경우 기존 연구를 통한 발생 원인은 아밀로이드 베타 및 타우 단백질이 뇌 속에 쌓이며 신경세포를 죽이는 독성 물질을 형성하는 것으로 알려져 있으나 보다 근본적인 발병 기전은 아직 밝혀지지 않아 치료제 개발에 걸림돌로 작용하고 있다.
서울대 공동연구진은 타우 단백질이 어떻게 분자 수준에서 섬유화되는지를 파악하기 위해 신경독성 물질 형성을 촉진하는 핵심 영역(응집 코어)에 초점을 맞춰 연구를 수행했다.
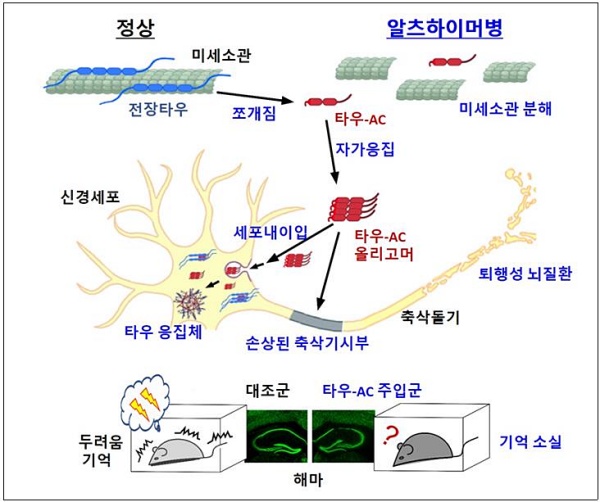
그 결과 내부 절단된 타우 단백질 일부분이 별도의 처리 없이 생리적 환경 조건에서 자발적으로 신경독성 물질을 형성할 수 있으며 정상 타우 단백질까지 신경독성 물질로 전환 시킬 수 있는 능력이 있음을 확인했다. 이는 단백질의 절단으로 특정 부위(응집 코어)가 노출되기 때문이었다.
추가적으로 타우 절단으로 생성된 신경독성 물질이 신경세포에 침투하는 경로와 추가적인 응집을 유도하는 과정 그리고 신경세포의 시냅스 가소성을 떨어뜨리는 현상 등을 규명해 세포 수준에서 이들의 병리 유도 기전을 확립할 수 있었다.
또한 동물모델 실험을 통해 타우 응집 코어를 생쥐의 뇌실 내 해마에 주입 시 신경세포 사멸과 신경염증 반응 및 기억력 감퇴 등 알츠하이머성 치매와 유사한 행동학적 변화가 일어나는 현상을 확인했다. 이를 통해 분자 및 세포 수준에서 규명한 타우 조각의 병리 기전이 동물모델에서도 재현됨을 알 수 있었다.
연구를 주도한 이민재 교수는 “이번 연구는 새로운 타우 단백질의 섬유화 및 신경독성 생성 원리를 분자와 세포 그리고 동물모델 수준으로 밝혀낸 것”이라며 “후속 연구를 통해 알츠하이머병의 새로운 치료 방법을 제시하는 데 기여하겠다”고 밝혔다.
그는 특히 “생화학·신경과학·생물리학 등 다양한 분야 연구자들의 협업과 고위험·고수익 기초연구에 대한 국가적 지원을 통해 이번 연구성과를 창출했다”며 창의적 R&D 활동에 대한 지속적인 정부 지원 필요성을 강조했다.
이번 연구는 치매극복연구개발사업단 지원을 통해 수행됐으며 국제학술지 ‘어드밴스드 사이언스’(Advanced Science) 2023년 8월 18일 온라인에 게재됐다.

