작년 49건으로 최근 5년새 8배 늘어…적용 질환 다양화
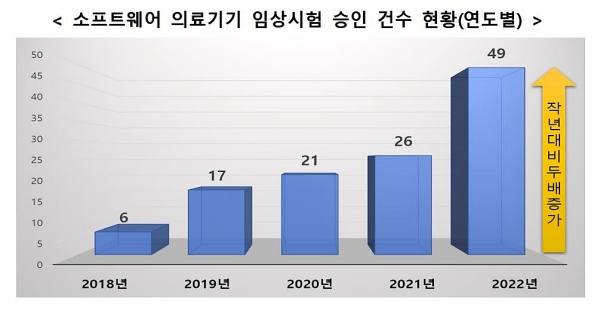
[라포르시안] 국내 소프트웨어 의료기기 임상시험 계획 승인 건수가 지난 5년간 꾸준히 증가하고 있는 것으로 나타났다.
식품의약품안전처(처장 오유경)는 국내 소프트웨어 의료기기 업계에서 새로운 제품을 연구·개발하는데 도움이 될 수 있도록 디지털 치료(보조)기기 등 소프트웨어 의료기기에 대한 2022년 임상시험 계획 승인 현황과 분야별 승인 제품 현황을 13일 공개했다.
식약처에 따르면 소프트웨어 의료기기 임상시험 계획 승인 건수는 2021년 26건에서 2022년 49건으로 증가했다.
분야별 승인 건수는 ▲인공지능(AI) 기반 소프트웨어 등 진단 보조·예측(31건) ▲디지털 치료(보조)기기 등 치료·완화(17건) ▲증강현실(AR) 기반 수술 보조 소프트웨어 등 수출·치료·보조(1건) 순으로 ‘진단 보조·예측’ 분야 제품이 다수를 차지했다.
특히 디지털 치료(보조)기기 분야는 2021년 9건의 임상시험 계획이 8개 질환에 대해 승인됐으나 지난해에는 17건의 임상시험 계획이 12개 질환에 대해 승인됐다.
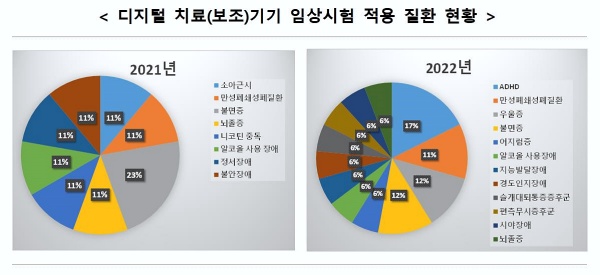
이는 디지털 치료(보조)기기가 그간 불면증이나 중독증상 완화를 위한 제품 개발이 주류였던 것과 비교해 지난해에는 ADHD(주의력결핍·과잉행동장애)·경도인지장애·발달장애 등 보다 다양한 질환 적용이 시도됐기 때문으로 풀이된다.
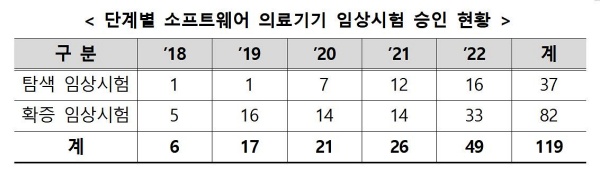
지난해 승인된 49건 중 개발 초기 단계 탐색 임상시험은 16건이었던 반면 허가를 위한 확증 임상시험이 33건으로 더 많았다.
다만 임상시험 수행 단계 기준 지난해 승인된 임상시험 계획 49건 중 현재 종료된 임상시험은 9건, 진행 중이 18건, 아직 개시하지 않은 임상시험이 22건으로 실제 의료현장에서 해당 제품이 사용되기까지 시간이 더 필요할 것으로 예상된다.
임상시험 계획 승인 제품 사례를 살펴보면 ‘진단 보조·예측’ 분야에서는 인공지능(AI) 기술을 적용해 ▲뇌 CT 영상을 이용한 급성 뇌경색 발생 여부와 발생 위치 진단 보조 ▲초음파영상에서 췌장암 영역 검출 보조 ▲심혈관 질환 환자의 의무기록을 분석해 1년 이내 심근경색 발생 위험 예측 ▲입원 환자의 혈압·심박·호흡 등을 분석해 급성 심정지 발생 예측하는 제품 등이 개발되고 있다.
‘치료·완화’ 영역에서는 ▲게임을 기반으로 ADHD 진단을 받은 소아 환자의 주의력 결핍 개선 ▲가상현실(VR) 기술을 활용해 우울장애 환자의 우울증 개선 치료 ▲생활 습관 변화를 유도해 알코올 사용 장애를 개선하는 제품 등이 개발 진행 중이다.
식약처는 “앞으로도 규제 과학적 지식과 전문성에 기반해 의료기기 관련 정보를 적극적으로 제공하고 관련 규제를 합리적으로 개선하겠다”며 “특히 신성장 산업으로 인식되고 있는 디지털 헬스케어 분야 핵심인 디지털 치료(보조)기기 등 소프트웨어 의료기기가 신속히 제품화될 수 있도록 임상시험 현황 등 업계에 유용한 정보를 지속 제공하며 업계와 소통하겠다”고 밝혔다.

