[라포르시안] 보건복지부는 27일 의료현장에 선(先)진입 가능한 의료기술 대상과 기간을 대폭 확대하고, 선진입 의료기술에 대한 안전관리를 강화하는 내용의 '신의료기술평가에관한 규칙' 개정안을 28일부터 시행한다고 밝혔다.
주요 내용을 보면 우선 선진입 가능한 의료기술이 확대된다. 새로운 의료기술의 빠른 의료현장 진입을 위해 신의료기술평가 유예 대상을 확대하고 유예요건을 완화했다. 의료현장에 선진입해 사용 가능한 기간도 연장했다.
평가유예 대상에서 제외됐던 ‘체외진단의료기기’가 대상에 포함되고, 안전성에 우려가 적은 비침습적 진단용 의료기기의 경우 ‘비교 임상문헌’이 아닌 식약처 허가 시 제출된 ‘임상시험에 관한 자료’만으로 평가유예 신청이 가능해진다.
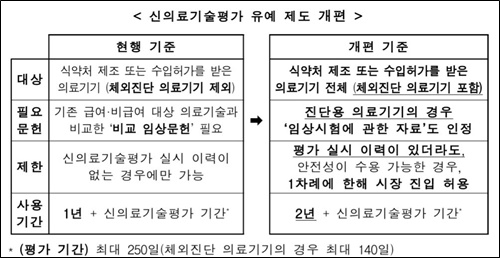
의료현장에 선진입해 사용 가능한 기간도 1년에서 2년으로 연장돼 안전성·유효성에 대한 문헌적 근거를 창출할 수 있는 기회도 확대된다. 신의료기술평가 이력이 있는 경우에도, 이미 실시된 평가에서 안전성의 우려가 없는 것으로 판단될 경우 선사용 기회가 한차례 부여된다.
선진입 의료기술에 대한 안전관리도 강화된다. 신의료기술평가 유예 대상을 확대하고 요건을 완화함에 따라 의료현장에 진입하기 전 전문위원회를 통해 안전성을 검토하고 신의료기술평가위원회에서 심의하는 절차를 신설했다.
또 ‘평가유예 신의료기술’, ‘제한적 의료기술’, ‘혁신의료기술’로 구분되어 각각의 위원회에서 관리하던 선진입 의료기술 관리주체를 하나의 위원회(근거창출전문위원회)로 일원화해 체계적인 과정 관리와 안전성에 대한 엄격한 검토를 수행한다.
선진입 의료기술 사용 중 부작용 발생 시 추가적인 위해 방지를 위해 심각한 부작용에 대한 보고를 의무화하고, 위해 수준 검토 및 사용 중단 등에 대한 사항도 명시적으로 구체화했다.
이창준 복지부 보건의료정책관은 “의료기술의 발전 촉진과 함께 국민들의 건강 보호를 위해 안전성에 우려가 적은 의료기술은 의료현장에 빠르게 진입할 수 있도록 관련 규제를 개선했다”면서 “복지부는 선진입 의료기술이 국민들에게 안전하게 제공될 수 있도록 과정 관리에 만전을 기하고 의료기술 발전을 위한 과학적 근거 창출도 적극 지원할 계획”이라고 했다.
한편 신의료기술평가 등에 관한 규칙 개정에 따라 신의료기술평가 유예 신청 및 진행 절차 등 변경되는 사항은 한국보건의료연구원에서 내달 8일 설명회를 개최하고, 절차 및 운영과 관련된 규정과 지침이 개정되는 시점부터 신청을 받을 예정이다.

