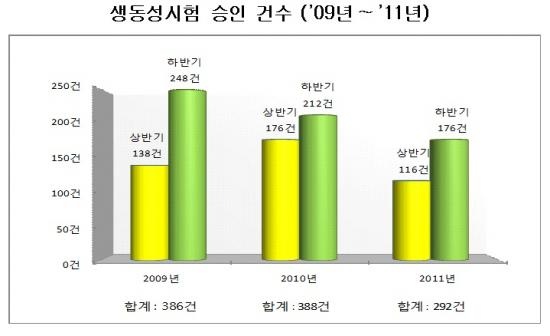
식약청은 2009~2010년에는 시장 비중이 큰 고혈압치료제 등의 대형 품목의 재심사가 만료돼 생동성시험 승인건수가 많았던 반면 지난해와 올해는 재심사나 특허가 만료되는 의약품 중 대형 품목이 적어 제네릭의약품 개발 건수가 감소한 것으로 해석했다.
의약품 성분별로 생동성 승인 건수를 보면 B형 간염 치료제인 ‘바라크루드정’의 제네릭의약품인 ‘엔테카비르’가 41건으로 가장 많았다.
골다공증 치료제인 ‘본비바정’의 제네릭의약품인 ‘이반드론산나트륨일수화물’이 35건으로 뒤를 이었으며 발기부전 치료제인 ‘비아그라정100mg’의 제네릭의약품인 ‘실데나필시트르산염’은 24건이 개발됐다.
약효군별로는 B형 간염치료제, 골다공증치료제 등이 포함된 기타 대사성 의약품이 123건(42.1%)이 승인을 받았으며 신경병증성 통증치료제와 간질 치료제 등이 포함된 중추신경계용의약품이 54건(18.5%), 발기부전 치료제, 요실금 치료제 등이 포함된 비뇨생식기관 및 항문용의약품은 31건(10.6%)이 개발됐다.
식약청 의약품안전국 약효동등성과 정수연 과장은 “아직까지 국내 제약사들의 의약품 개발이 신약의 재심사와 물질특허 만료기간에 크게 좌우되고 있다”며 “앞으로 제약업계가 제네릭의약품 개발동향을 신속히 알 수 있도록 분기별로 생동성시험 계획성 승인현황을 분석해 발표할 예정”이라고 말했다.
손의식 기자
hovinlove@rapportian.com
다른기사 
