히알루론산 점안제 재평가 대상에 427품목 선정
급여 퇴출 대비한 대체품목 도입에 관심
[라포르시안] 내년도 급여적정성 재평가 대상에 히알루론산 점안제가 포함되면서 안구건조증 치료제 시장에서 품목 교체를 위한 발빠른 변화가 진행되고 있다. 특히 국제약품과 삼일제약은 최근 ‘레바미피드’ 2% 성분의 안구건조증 치료제를 출시하면서 안과용제 제약사 중 가장 빠른 행보를 보이고 있다.
그러나 제약업계 일각에서는 레바미피드 성분 고유의 쓴맛과 2%의 농도에서 오는 이물감에 대한 대안 없이는 승부가 쉽지 않을 것이라는 예측도 있다.
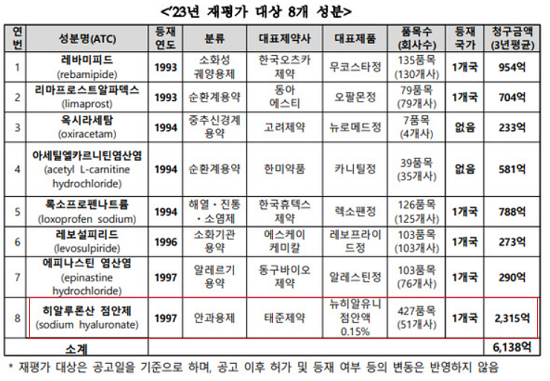
지난 2월 건강보험심사평가원 약제급여평가위원회는 2023년 기등재의약품 급여적정성 재평가 대상으로 선정된 8개 성분을 발표했다. 이 중 히알루론산 점안제는 급여적정성 재평가 대상으로 선정된 성분 중 품목 수도 가장 많고(51개사 427품목), 3년 평균 청구액도 2,315억원으로 가장 많다.
급여적정성 재평가 결과를 통해 급여에서 제외되면 시장에서 퇴출을 의미하는 만큼 안과용제 제약사들은 위기감을 느끼면서 급여권을 사수하기 위한 대응 방안 마련에 한창인 것으로 알려졌다. 이와 함께 히알루론산 점안액 퇴출 시 매출 공백을 메울 수 있는 대체 품목 도입을 위한 노력도 진행 중이다.
국제약품과 삼일제약은 지난달 안구건조증치료제 ‘레바아이점안액2%’와 ‘레바케이점안액’를 각각 식약처로부터 허가받았다. 두 점안제는 국내 최초로 레바미피드를 주성분으로 허가를 받았다는 점에서 주목을 받고 있다.
레바미피드는 1981년 일본의 오츠카제약에서 합성한 퀴놀리논 유도체로, ‘무코스타’라는 이름으로 위궤양 또는 위염 치료에 사용되다가, 점안제로 사용시 안구의 뮤신 분비가 증가하고 각막 및 결막 상피 장애가 개선되는 등의 치료에도 효과가 있는 것으로 알려졌다.
이후 2012년 일본에서 안약으로 먼저 개발돼 무코스타 점안액 UD 2%으로 사용돼 왔으나, 국내에는 동일 성분의 점안제는 출시되거나 수입되지 않다가 국제약품과 삼일제약이 처음으로 출시했다.
국제약품과 삼일제약은 히알루론산과 디쿠아포솔나트륨 성분이 주를 이루던 안구건조증 시장에 최초로 레바미피드 성분의 점안액을 출시하면서 단기적으로는 새로운 안구건조증 치료제 옵션을 확보하고 장기적으로는 급여적정성 재평가 이후의 시장을 선점할 것이라는 게 제약업계의 분석이다.
A제약사 안과마케팅 팀장은 “히알루론산 점안제가 내년 건강보험약제 급여적정성 재평가에서 급여가 제외되면 어쩔 수 없이 다른 품목으로 교체해야 하고, 가장 근사치에 있는 성분을 꼽자면 레바미피드라고 할 수 있다”라며 “현재 시장에 히알루론산과 디쿠아포솔이 있는 상황에서 최근 레바미피드 성분의 점안제를 허가받은 것은 급여적정성 재평가 이후의 안구건조증 치료제 시장을 선점하려는 의지가 반영됐을 것이다”라고 전했다.
그는 “영업을 다니면서 안과 전문의들에게 안구건조증 치료제로 레바미피드에 대한 이야기를 꺼내보면 아직은 크게 관심이 없어 보인다”라며 “그러나 시장에서 히알루론산이 빠지게 되면 안과에서도 관심도 높아질 것 같다”고 말했다.
레바미피드 2%로는 히알루론산 시장을 대체하기에 한계가 있다는 주장도 제기됐다.
B제약사 관계자는 “해외 논문을 보면 레바미피드의 유일한 부작용으로 쓴맛을 꼽고 있다”라며 “최근 국내에서 허가 받은 레바미피드 성분의 안구건조증 치료제의 경우 쓴맛을 잡았다고 하는데 제품이 출시돼야 정확히 알 수 있을 것”이라고 밝혔다.
고농도에 따른 이물감도 해결해야 할 과제로 꼽았다.
이 관계자는 “점안제에서 점안감은 상당히 중요한 요소이다. 농도가 높으면 점안 시 뻑뻑하고 이물감이 느껴진다”며 “히알루론산도 0.1%와 0.3% 간의 점안감이 다르다. 2%라는 고농도에서 오는 점안감을 어떻게 해결해야 할 지도 고민해야 한다”고 강조했다.
이런 이유로 일부 국내 제약사에서는 레바미피드 1.5%를 출시하기 위한 연구를 진행 중인 것으로 알려졌다.
레바미피드 1.5% 안구건조증 치료제의 허가임상을 진행 중인 C제약사 관계자는 “1.5%는 2%와 비교해서 점안감도 편하지만 보험약가도 경쟁력이 있다”라며 “1.5%는 2%가 받는 보험약가의 85% 수준이라 환자 부담이 낮아 처방이 수월하다는 장점이 있다”고 설명했다.
그는 “최근 허가받은 레바미피드 2%가 멀티도즈(다회용)인데 비해 자사가 개발 중인 레바미피드 1.5%는 모노도즈(일회용)이라는 것도 차별점”이라며 “임상이 끝나봐야 알겠지만 지금까지 연구에서는 1.5%와 2%의 효과 차이가 없는 것으로 나오고 있다. 2024년에 제품을 출시할 예정”이라고 말했다.

