의회 보고서 통해 문제 제기돼…"현지 법규정 어기고 문맹 참가자들에게 동의 구하지 않아"
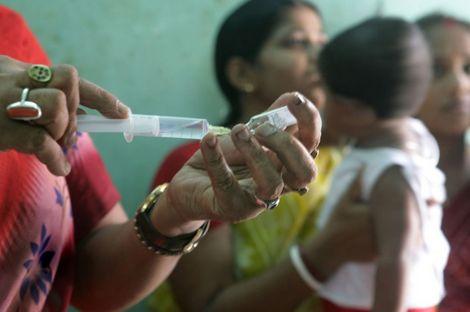
지난 6월 일본에서 자궁경부암을 예방하기 위한 인유두종 바이러스(HPV) 백신의 부작용 논란이 제기된 데 이어 이번엔 인도에서 HPV 백신 임상시험이 비윤리적으로 시행됐다는 의혹이 불거졌다.
영국의 과학전문잡지 '네이처 온라인판'(www.nature.com)은 지난 9일자로 이 같은 내용을 보도했다.
이 기사에 따르면 인도 의회는 자국 내에서 시행될 HPV 프로그램을 진행하는 동안 윤리적 기준 및 관련 법 규정을 위반할 가능성이 있는 미국 주요 보건기구에 대해 법적 조치를 취할 방침이다.
앞서 인도 정부는 2008년 미국의 다국적 제약사 머크(Merck)에서 제조한 '가다실'과 영국의 글락소스미스클린(GlaxoSmithKline)사가 제조한 '서바릭스'의 판매를 허가했다.
이듬해인 2009년부터 인도에서 미국의 비영리 기관인 PATH(Program for Appropriate Technology in Health)와 일부 인도내 기관을 중심으로 HPV 백신에 대한 인식을 높이고, 학교와 보건소 중 어느 곳이 접종 장소로 적합한 지를 알아보기 위한 목적으로 추진됐다.
임상시험을 주도한 PATH는 필요한 자금은 빌&멜린다 게이츠 기금(Bill and Melinda Gates Foundation)으로부터 지원을 받았다.
임상시험은 인도 동남부의 안드라 프라데시(Andhra Pradesh) 주에 거주하는 10~14세 여자 아이 1만3,000명에게 가다실을 접종하고, 서부의 구자라트(Gujarat)주에 거주하는 같은 연령대의 여자 아이 1만명에게는 서바릭스를 접종하는 방식으로 이뤄졌다.
당초 이번 임상시험은 2011년까지 진행할 예정이었으나 HPV 백신을 접종한 후 7명의 여자 아이가 사망하면서 안정성과 임상시험의 윤리성 위반 문제가 제기되자 인도 정부는 지난 2010년 3월 연구를 중단시켰다.
이후 2011년 인도 정부 측은 "사망자들의 사망 원인이 백신과 무관하며 일말의 윤리적 기준을 위반한 적이 없다"고 조사 결과를 발표했다.
그런데 올해 8월 30일 공개된 인도 의회 상임위원회의 보고서를 통해 PATH가 임상시험 과정에서 윤리적 기준 및 인도법과 규정을 위반했다는 의혹이 제기되면서 논란이 커지고 있다.
네이처 온라인판 보도에 따르면 인도 상임위의 보고서는 PATH가 임상시험의 적합한 절차를 따르지 않은 점과 다수의 문맹이 포함된 참가자들 모두의 동의를 구하지 않은 점, 임상시험 과정을 충분히 모니터링 하지 않은 점 등을 지적했다.
보고서는 "PATH뿐만 아니라 안드라 프라데시 및 구자라트 지방자치기구, 인도 의학연구회의(ICMR)에도 책임이 있다"고 비난했다.
특히 인도 의회는 뚜렷한 증거는 없지만 다국적 제약사들이 이익을 추구하기 위해 농간을 부린 것이 아닐까 하는 의혹을 제기했다.
하지만 이 임상시험을 수행했던 담당자들은 HPV 백신 프로그램에 대해 제기된 부작용 문제 등에 대해서 강력히 반발하고 있다.
자궁경부암 예방 프로젝트를 이끌던 PATH의 비비안 츄(Vivien Tsu)는 "이번 연구의 목적이 얼마나 많은 여자 아이들에게 백신을 투여할 수 있는지를 결정하는 임상시험이었기 때문에 일반적인 임상에 따른 경과를 측정할 필요가 없었다"며 "인도 의회의 보고서에 세부적으로 부정확한 내용이 많고 임상시험 절차를 어겼다고 주장하는 것은 부당하다"고 반발했다.
그는 "PATH는 빌&멜린다 게이츠 기금에서 2780만 달러라는 거금을 지원받으면서 인도에서 시행한 것과 유사한 임상시험을 베트남, 우간다, 페루에서 2006년부터 시행하고 있다"며 "이 연구의 목적은 가난한 나라에 백신을 전파하는 실행 가능성 및 순응도에 대한 활용 데이터를 제공하기 위한 것"이라고 주장했다.
PATH도 지난 3일자로 홈페이지에 성명서를 올리고 인도 의회 보고서에서 제기한 의혹을 전면 부인했다.
PATH는 통해 "인도 상임위원회 보고서에 명시된 문제점과 결론, 증거, 사실 여부에 대해 동의할 수 없다"며 "이 연구에 사용된 백신은 머크와 GSK에서 기증된 것으로, 제약사가 임상시험의 설계와 평가에 참여 하지 않았다"고 밝혔다.
PATH는 또 "페루 및 우간다에 시범적으로 시행한 프로젝트가 국가 차원의 HPV 면역 프로그램 시행을 도왔으며, 세계백신면역연합(GAVI Alliance)이 최빈국에 대한 HPV 백신 접종 보조금을 지원하도록 하는데 일조한 바 있다"고 강조했다.

