작년에만 FDA·EMA서 10개 제품 허가...“국산 신약, 머잖아 해외서도 성공 가능성 제시”

[라포르시안] 그동안 국내 제약바이오기업들이 미국 식품의약국(FDA)과 유럽의약품청(EMA)으로부터 판매허가를 획득한 의약품이 40여개에 달하는 것으로 나타났다.
FDA와 EMA는 전 세계에서 의약품 인허가 규제가 가장 엄격하다고 알려진 국제기관으로, 국산신약이 글로벌 제약시장에서도 성공할 수 있다는 가능성을 보여주고 있다.
23일 한국제약바이오협회 ‘제약바이오산업 미국·유럽시장 의약품 승인현황’ 자료에 따르면 2003년 이후부터 최근까지 국내 제약바이오기업이 미 FDA와 EMA로부터 의약품 판매허가를 획득한 건수가 39건에 달했다.
작년 한 해에만 FDA와 EMA에서 10건의 의약품 인허가가 이뤄졌다. 특히 지난해 미국 FDA 허가는 8건으로 역대 최다 건수를 기록했다.
지역별로 보면 미국 FDA로부터는 23개, EMA로부터는 16개 의약품이 승인을 받았다.
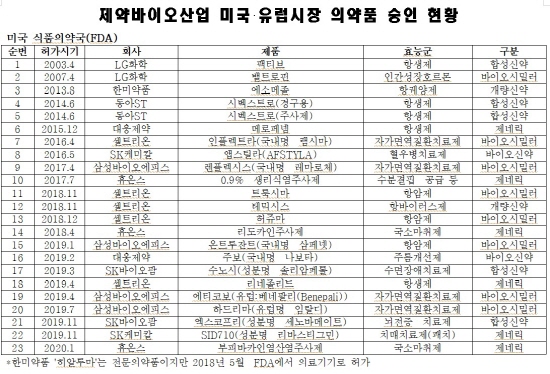
FDA 장벽을 처음으로 넘은 국내 제약기업의 제품은 LG화학(LG생명과학) 퀴놀론계 항생제 ‘팩티브’였다. 팩티브는 지난 2003년 4월 FDA로부터 허가를 받았다.
팩티브는 매출의 대부분이 국내보다는 해외에서 발생하고 있는데, 글로벌 시장에서 연간 약 200억원의 매출을 기록하고 있는 것으로 알려졌다.
동아ST의 슈퍼박테리아 타깃 항생제 ‘시벡스트로’는 경구용과 주사제 모두 FDA 허가를 받았다.
시벡스트로는 테디졸리드포스페이트를 주성분으로 하는 항생제로, 대표적 항생제 내성균인 '메티실린-내성 황색포도상구균(MRSA)'을 포함한 그람양성균이 유발하는 급성 세균성 피부염 환자에 사용하는 신약이다.
가장 최근에는 휴온스가 올해 1월 국소마취제 ‘부피바카인염산염주사제’를 FDA로부터 제네릭으로 허가를 받았다.
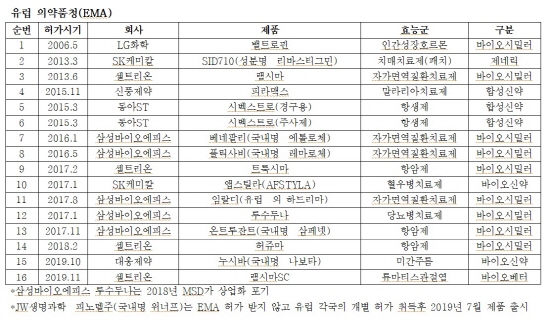
EMA로부터 첫 허가를 획득한 의약품은 LG화학의 인간성장호르몬 ‘밸트로핀’으로, 2006년 5월에 승인을 받았다. 이어 2013년 3월 SK케미칼 치매치료제 ‘SID710’, 같은 해 6월 셀트리온의 바이오시밀러 ‘램시마’, 2015년 11월 신풍제약 말라리아치료제 ‘피라맥스’가 잇따라 허가를 획득했다.
가장 최근에 EMA로부터 허가를 획득한 제품은 셀트리온의 류마티스관절염 '램시마SC'였다.
제약업계 한 관계자는 “국내 의약품이 FDA와 EMA에서 허가를 받는다는 건 그만큼 연구개발 기술력을 세계시장에서도 인정받고 있다는 방증”이라며 “국내 개발 신약 중에서 머지않아 글로벌 블록버스터급 신약이 등장할 것으로 기대한다”고 말했다.

