한미약품·유한양행·유유제약·메디포스트 등 해외 학회서 신약 연구결과 속속 공개
[라포르시안] ‘인보사 사태’로 제약·바이오업계가 뒤숭숭한 가운데 미국 등 글로벌 무대에서 K-바이오의 경쟁력을 잇따라 입증하면서 향후 ‘블록버스터 신약' 탄생 가능성을 높여가고 있다.
11일 제약업계에 따르면 한미약품은 최근 미국 샌프란시스코에서 열린 제79회 미국당뇨병학회(ADA)에서 자체 개발한 플랫폼 기술 ‘랩스커버리’가 적용된 바이오신약 후보물질 3종에 대한 총 12건의 연구결과를 발표했다.
ADA에서 발표한 한미약품의 바이오신약 3종은 글로벌 제약사 사노피에 라이선스 아웃된 ‘에페글레나타이드’와 한미약품이 비알코올성지방간염(NASH) 치료제로 개발 중인 ‘LAPSTriple Agonist’, 비만과 희귀질환 치료제(선천성고인슐린증) 등으로 개발 예정인 ‘LAPSGlucagon Analog’이다.
특히 이번 ADA에서 한미약품은 사노피와 공동발표를 통해 에페글레나타이드의 혈당 및 체중 조절 등 다양한 효능들을 선보여 참가자들의 주목을 받았다.
권세창 한미약품 사장은 “이번 발표는 한미약품 플랫폼 기술인 랩스커버리를 적용한 다양한 바이오신약들의 글로벌 경쟁력을 글로벌 무대에 선보이고 평가받는 좋은 기회가 됐다”며 “랩스커버리 적용 파이프라인의 임상 순항과 플랫폼 기술 활용 치료영역 확장을 위한 노력에 더욱 박차를 가하겠다”고 강조했다.
유한양행은 미국임상종양학회(ASCO)에서 비소세포폐암 치료제 신약으로 개발 중인 ‘레이저티닙(YH25448)의 임상1/2상 최신 업데이트 결과를 발표했다.
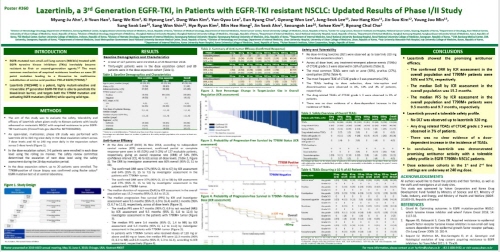
레이저티닙은 상피세포성장인자수용체(EGFR) 유전자에 기존 치료제 투여 후 발생한 ‘T790M’ 돌연변이가 있는 국소 진행 또는 전이성 비소세포폐암에 대한 표적 치료제이다.
임상 결과에 따르면 전체 127명 환자 중 암의 크기가 30%이상 감소해 객관적 반응을 보인 환자의 비율 (ORR)은 54% 이었고, 그 중 기존 항암제에 저항성을 나타내는 T790M 돌연변이 양성 환자는 57%를 나타냈다.
암이 완전히 사라진 완전관해(CR) 상태를 보인 환자도 3명이 확인됐다.
유한양행 관계자는 “현재 한국에서 진행중인 임상1/2상 시험을 미국으로 확장하는 폐암환자대상 임상1상 시험이 지난 5월 30일 미국식품의약국으로부터 승인 받았다”며 “미국에서 환자 모집은 올해 3분기 중 시작될 예정으로 글로벌 임상개발을 위해 박차를 가하고 있다”고 말했다.
유유제약은 세계 최대 규모의 바이오 컨퍼런스 ‘바이오 USA 2019’에서 전립선비대증 개량신약과 안구건조증 펩타이드 신약 등 주요 파이프라인의 개발 현황을 발표했다.

전립선 비대증 치료 개량신약(YY-201)은 세계 최초 두타스테리드와 타다라필 복합제형으로 환자 복용 편의성을 높인 축소제형이다. 현재 해외 특허 출원 및 등록 중에 있으며 임상 3상을 승인받아 올해 안으로 환자를 등록해 임상을 진행하는 것을 목표로 하고 있다.
메디포스트 역시 바이오 USA 2019에서 자사 줄기세포치료제 파이프라인 개발과 미국에서의 임상시험 등을 발표했다.
무릎골관절염 치료제 ‘카티스템’은 지난해 미국 임상 1/2a상을 종료했고, 기관지폐이형성증치료제 ‘뉴모스템’은 올해 1월 미국 임상 1/2상을 마친 상황이다.
메디포스트는 카티스템과 뉴모스템은 글로벌 진출을 위한 라이선스 아웃을 목표로 하고 있고 연내에 미 FDA와 차상위 임상 진행에 대한 논의를 진행할 예정이다.

