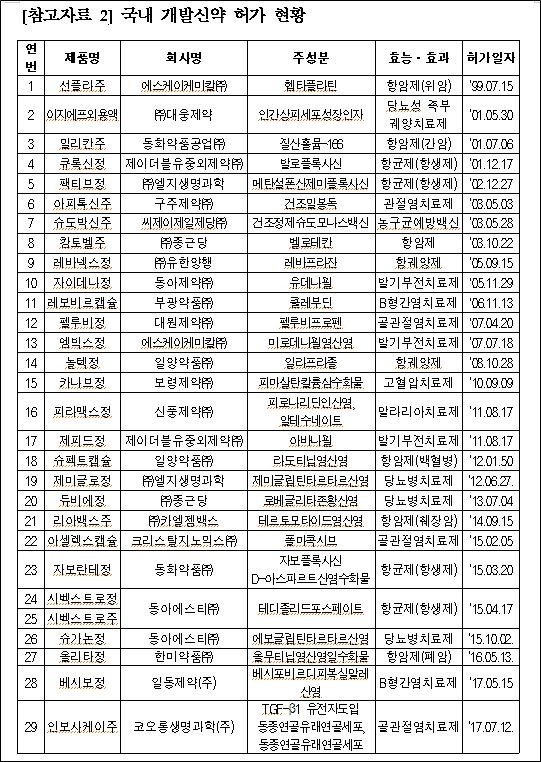
[라포르시안] 코오롱제약의 무릎골관절염 유전자치료제 '인보사케이주'가 식품의약품안전처의 시판 허가를 받았다.
국내 개발 유전자치료제로는 처음이며, 국내 신약으로는 29번째다.
식약처는 12일 코오롱제약의 '인보사케이주'를 허가했다고 밝혔다.
인보사케이는 항염증 작용을 나타내는 'TGF-β1 유전자'가 도입된 동종연골유래골세포가 주성분이다.
효능 효과는 '약물이나 물리치료에도 통증 등이 지속되는 중증도 무릎 골관절염환자의 치료'이며, 무릎관절강내 1회 주사한다.
현재까지 미국, 유럽 등 주요 제약선진국이 허가한 유전자치료제는 4개 품목이지만 퇴행성 질환인 무릎 골관절염 치료를 위한 유전자치료제는 인보사케이가 처음이라고 설명했다.
식약처는 인보사케이를 허가·심사하는 단계에서 ▲해당제품 투여 후 통증과 관절기능 개선 정도 ▲연골 구조 개선 효과 ▲제품 투여 후 발생하는 이상반응 ▲제품 투여 후 장기추적조사를 통해 뒤늦게 나타나는 이상반응 등 자료를 중점적으로 검토했다.
유효성의 경우 중등도의 무릎 골관절염 환자를 대상으로 해당 제품을 1회 주사하고 1년 후 환자가 느끼는 무릎 통증 개선 정도와 운동이나 일상생활 등에서의 기능 개선 정도를 대조군(생리식염수 투여군)과 비교한 결과 유효성을 입증했다.
기능 개선 정도는 무릎관절 부위의 뻣뻣함·부종 등 증상 정도, 뛰기, 테니스 등 운동 가능 정도, 계단 오르기 장보기 등 일상생활에서의 활동 가능 정도 등을 종합해 평가했다.
다만, MRI 등을 통해 손상된 연골 재생 등 구조개선 효과를 확인한 결과는 대조군과 차이가 없었다.
안전성도 입증됐다. 주사부위 국소반응(통증, 부종 등)과 전신반응(열감, 두드러기 등)을 평가한 결과 안전했으며, 제품을 투여한 100여명 환자 각각을 3∼10년간 별도로 추적 조사한 임상시험에서 지연 반응(종양, TGF-β1 농도 상승 등) 등을 평가한 결과에서도 안전한 것으로 나타났다.
식약처는 "지난 2014년부터 바이오 업체의 개발을 지원하기 위해 '마중물사업'을 운영하고 있다"며 "이번 유전자치료제도 마중물사업을 통해 품질관리 기준 설정 등에 대한 밀착 상담을 받아 개발 과정 중 시행착오를 최소화 할 수 있었다"고 말했다.