지난해 생물학적 동등성시험 승인이 심혈관계, 정신신경계, 소화계 의약품에 집중된 것으로 나타났다.
12일 식품의약품안전청에 따르면 2012년 생동성시험 승인건수는 총 201건으로 전년(292건) 대비 30% 감소했으며, 이중 치료영역별로는 심혈관계 의약품이 82건(41%)으로 가장 많았다.
다음으로 신경계의약품이 36건(18%), 소화계의약품이 28건(14%)을 차지했다.
심혈관계 의약품의 경우 고혈압치료제 개발이 활기를 띄면서 2011년 29건에 불과했으나 지난 해에는 66건까지 증가해 상승폭이 가장 큰 것으로 분석됐다.
반면 골다공증치료제 등 대사성의약품의 경우 시장 점유율이 높은 '이반드론산' 등의 성분 재심사가 대부분 2011년에 만료돼 2012년에는 12건(2011년 123건)에 그쳤다.
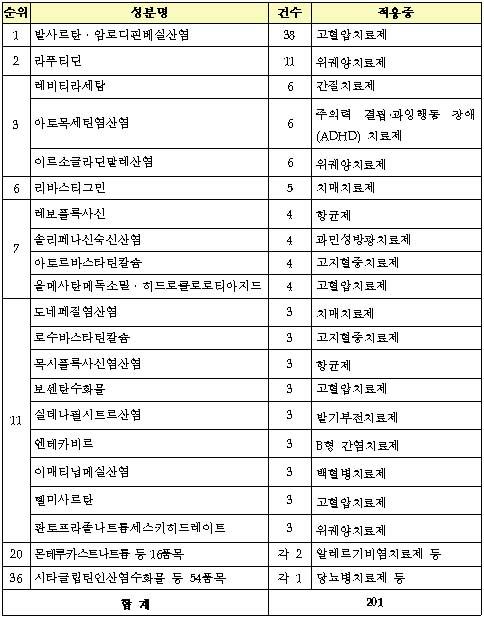
성분별로는 고혈압치료제가 66건(33%)으로 가장 많았으며, 특히 복합제가 48건으로 대부분을 차지했다.
복합제 중에는 올해 상반기에 재심사가 만료되는 ‘발사르탄·암로디핀베실산염 복합제(엑스포지정?)’의 승인이 38건으로 가장 많았다.
다음으로 소화성궤양치료제 ‘라푸티딘(스토가정?)’이 11건으로 많이 승인됐고 간질치료제 ‘레비티라세탐(케프라정?)’, 과잉행동 장애(ADHD)치료제 ‘아토목세틴염산염(스트라테라캡슐?)’ 및 소화성궤양치료제 ‘이르소글라딘말레산염(가스론엔정?)’이 각각 6건씩 승인됐다.
제네릭의약품을 개발을 위해 국내에서 처음으로 생동성시험 승인을 받은 성분은 소화성궤양치료제 ‘이르소글라딘말레산염’(6건), 치매치료제 ‘리바스티그민’(5건), 고혈압치료제 ‘보센탄수화물’(3건), 종양치료제 ‘테가푸르·기메라실·오테라실칼륨 복합제’(2건), 야뇨증치료제 ‘데스모프레신아세트산염’(1건) 등 총 23개였다.
식약청은 "생물학적 동등성시험의 신뢰성 확보를 위해 승인 심사시 피험자 안전 및 부작용 관리를 중점적으로 검토하고, 생동성 시험이 국제 수준으로 수행되도록 적극 지원할 계획"이라고 밝혔다.

