[라포르시안] 우리나라 줄기세포치료제 임상연구 건수가 세계에서 2번째로 많은 것으로 나타났다.
식품의약품안전처 식품의약품안전평가원은 24일 국내·외 줄기세포치료제 임상연구 동향을 국가별, 질환별 등으로 분석한 '줄기세포치료제 개발 및 규제동향 2016'보고서를 발간했다고 밝혔다.
보고서는 1999~2016년 미국 임상등록 사이트(www.clinicaltrials.gov)에 등록된 1,570여건의 줄기세포치료제 연구 중 제약사 등이 제품 개발을 위해 진행하는 임상연구 314건의 정보를 분석·제공한 것이다.
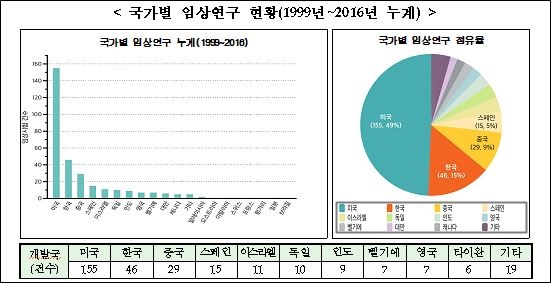
우선, 국가별 줄기세포 치료제 임상연구 건수는 미국이 155건으로 가장 많고 한국(46건), 중국(29건), 스페인(15건), 이스라엘(11건) 순으로 뒤를 이었다.
지난해 새로 등록된 임상연구 47건도 미국이 23건으로 가장 많고, 중국 8건, 한국 5건, 대만 3건 등이 뒤를 이었다.
임상연구를 대상 질환별로 분석하면 신경계(49건), 근골격계(48건) 심장(42건), 혈관(31건), 위장관계(27건), 면역계(21건), 폐(19건) 등의 순이었다.
지난해 새로 등록된 임상연구(47건)중 신경계가 13건으로 가장 많았으며, 폐 7건, 혈관·근골격계·피부가 각각 4건으로 뒤를 이었고, 심장질환에 대한 신규 임상연구는 1건에 그쳤다.
국가별 대상질환 임상연구의 경우 미국은 심장질환 30건(19%), 신경계 22건(14%), 근골격계 21건(13%) 등 연구가 활발히 이루어지고 있고 한국은 신경계 10건(22%), 피부 10건(22%), 근골격계 9건(20%) 등의 분야에서 연구가 이루어지고 있는 것으로 나타났다.
임상연구에 사용되는 줄기세포의 기원은 골수유래 줄기세포(117건, 37%)으로 가장 많았고 지방(75건, 23%), 제대혈(50건, 16%)등의 순이었다.
자신의 세포를 사용하는 자가유래세포 (156건, 46%)와 다른 사람의 세포를 사용하는 동종유래세포(161건,56%)는 비슷한 수준이었다.
보고서는 국외 줄기세포 치료제 규제 동향도 분석해 실었다.
유럽은 첨단 바이오의약품의 신속한 개발 지원을 위해 개발초기 단계부터 규제기관이 지원하는 신속개발지원제도(PRIME)를 지난해 3월부터 운영하고 있다.
PRIME은 심사대상 지정을 통한 의약품 허가를 지원하는 신설된 신속개발지원제도다.
미국은 2012년부터 기존 시판 치료제에 비해 효과 등이 현저하게 개선된 제품에 대해 개발을 지원하는 혁신치료제 지정제도를 운영하고 있다. 일본은 제품 개발 지원을 위해 개별면담, 사전면담, 대면 조언으로 상담프로그램을 나눠 운영하고 있다.
우리나라는 기존 치료제에 비해 안전성·유효성이 현저히 개선된 의약품 개발을 촉진해 치명적 중증질환자에게 치료기회를 확대하기 위한'획기적 의약품 및 공중보건 위기대응 의약품 개발촉진법'이 국회에 머물러 있다.
안전평가원은 "이번 보고서가 줄기세포 연구개발에 도움이 될 것"이라며 "줄기세포치료제와 관련된 연구 개발 동향 및 관련 제도 등에 대한 정보를 지속적으로 제공할 계획"이라고 밝혔다.

